Al mirar a nuestro alrededor se observa que las plantas crecen, los animales se trasladan y que las máquinas y herramientas realizan las más variadas tareas. Todas estas actividades tienen en común que precisan del concurso de la energía.
La energía es una propiedad asociada a los objetos y sustancias y se manifiesta en las transformaciones que ocurren en la naturaleza.
La energía se manifiesta en los cambios físicos, por ejemplo, al elevar un objeto, transportarlo, deformarlo o calentarlo.
La energía está presente también en los cambios químicos, como al quemar un trozo de madera o en la descomposición de agua mediante la corriente eléctrica.
| |||||||||||||||||||||||||
La energía es una magnitud cuya unidad de medida en el S.I. es joule
La Energía mecánica es la producida por fuerzas
de tipo mecánico, como la elasticidad, la gravitación, etc., y la poseen los cuerpos por el hecho de moverse o de encontrarse desplazados de su posición de equilibrio. Puede ser de dos tipos: Energía cinética y energía potencial (gravitatoria y elástica):
| |||||||||||||||||||||||||
sábado, 31 de marzo de 2012
La energía
jueves, 29 de marzo de 2012
Descubre....
Pasta de dientes para elefantes
En esta práctica vamos a recordar tanto la medida de volúmenes como la utilización de la balanza. También vamos a comprobar la descomposición del agua oxigenada (H2 o2), catalizada por el yoduro de potasio (KI). La reacción de descomposición del agua oxigenada es:
2H2O2 (aq) --> 2H2O(l) + O2 (g)
El yoduro de potasio (KI) es un catalizador porque solo aumenta la velocidad de reacción, no se gasta como reactivo. Sin embargo, una pequeña parte si que reacciona, convirtiéndose en yodo. La presencia del yodo se pone de manifiesto por el color marrón de algunas zonas del producto. El yodo mancha. La reacción se realiza en una probeta graduada bastante alta, ya que el producto formado sale verticalmente hacia arriba y de forma rápida. Por eso y por su textura, se llama “pasta de dientes”. Como el agua oxigenada es un oxidante muy fuerte hay que protegerse las manos con guantes. Además, como la reacción es muy rápida, es conveniente llevar gafas protectoras.
MATERIAL
2H2O2 (aq) --> 2H2O(l) + O2 (g)
El yoduro de potasio (KI) es un catalizador porque solo aumenta la velocidad de reacción, no se gasta como reactivo. Sin embargo, una pequeña parte si que reacciona, convirtiéndose en yodo. La presencia del yodo se pone de manifiesto por el color marrón de algunas zonas del producto. El yodo mancha. La reacción se realiza en una probeta graduada bastante alta, ya que el producto formado sale verticalmente hacia arriba y de forma rápida. Por eso y por su textura, se llama “pasta de dientes”. Como el agua oxigenada es un oxidante muy fuerte hay que protegerse las manos con guantes. Además, como la reacción es muy rápida, es conveniente llevar gafas protectoras.
MATERIAL
Probeta graduada de 250 ml, probeta graduada de 100 ml, vidrio de reloj, balanza, guantes, gafas de seguridad, protector de plástico (opcional), astilla (opcional).
Productos:
Colorante (opcional), detergente líquido (a ser posible, blanco y de pH = 7), agua oxigenada (H202) del 30%, yoduro de potasio (KI).
PROCEDIMIENTO
1. Coloca el protector de plástico sobre la mesa para evitar que se manche.
2. Pesa en el vidrio de reloj 15 g de yoduro potásico (KI) y colócalos en el erlenmeyer.
3. Añade la mínima cantidad de agua necesaria para disolverlo. Agita hasta que se disuelva del todo.
4. Ponte los guantes de goma y mide 40 ml de agua oxigenada del 30% en la probeta de 100 ml y viértelos en la probeta de 250 ml.
5. Añade unos 20 ml de detergente líquido y remueve (haciendo remolino) hasta que el agua oxigenada y el detergente se mezclen.
6. Si quieres, añade un poco de colorante en algunos puntos de la boca de la probeta para que la pasta de dientes salga rayada.
7. Añade la disolución de yoduro de potasio a la probeta y aparta la mano rápidamente. Retírate un poco de la probeta.
8. Puedes acercar una astilla encendida a la boca de la probeta y observar lo que ocurre.
miércoles, 28 de marzo de 2012
National Geographic
SABÍAS QUE.... EN NATIONAL GEOGRAPHIC
VISITA NUESTRO NUEVO LINK QUE SE ENCUENTRA EN LA
BARRA LATERAL ¨PÁGINAS¨ AHI ENCONTRARAS MUCHO
SOBRE SABÍAS QUE... DE TODO TIPO E INTERES.
TE GUSTARA.
martes, 27 de marzo de 2012

¿ De qué está hecha la mermelada?
La mermelada, según la Real Academia Española (RAE), es una “conserva de membrillos o de otras frutas, con miel o azúcar”. Es decir, podemos sintetizar y decir que la mermelada es fruta y azúcar . Además, hay que dejar claro que la mermelada no es lo mismo que la confitura, aunque compartan ciertas cualidades, ya que la confitura es mucho más concentrada que la mermelada y tiene más cantidad de azúcar. Digamos que son diferentes en cuanto a textura se refiere.
La mermelada empezó a fabricarse en torno a los años 30. En la actualidad, son muchos los tipos de mermeladas que puedes encontrar en los supermercados. Mermeladas de todos los sabores y cualidades. Las hay de cereza, de naranja, de frambuesa, de fresa, de melocotón o de ciruela, entre otras muchas. Precisamente la de ciruela es una de las más recomendables, ya que favorece el tránsito intestinal.
Además, es un producto sano y natural, por lo que las mermeladas bajas en calorías suponen un aliciente más para decantarse por ellas. Precisamente, en cuanto a calorías se refiere, una ración diaria (de 20-25 gramos) contiene cerca de 45 calorías.
Por otro lado, las mermeladas no llevan conservantes (o no deberían llevarlos). El azúcar es un excelente conservante natural. De hecho, la mermelada nació para conservar la fruta de manera natural. No se conocen alergias a la mermelada.
¿ Cómo se hace?
EJEMPLO: MERMELADA DE FRESA.....YUUUMIII
domingo, 25 de marzo de 2012
Metales y no metales
METALES ??
Las características de los elementos METALICOS son:
Las características de los elementos METALICOS son:
- Conducen con facilidad el calor y la electricidad.
- Presentan brillo metálico
- Generalmente pueden ser laminados o estirados formando alambres, propiedades que se conocen como MALEABILIDAD y DUCTILIDAD.
- Por lo regular a temperatura ambiente son sólidos excepto Hg, Ga, Cs y Fr.
- Al combinarse con NO METALES ceden electrones por lo que adquieren cargas positivas (CATIONES).
Los NO METALES presentan las siguientes características:
- Son malos conductores del calor y la electricidad.
- No son maleables ni dúctiles.
- Reciben electrones al combinarse con los METALES adquiriendo así cargas NEGATIVAS (ANIONES).
- Algunos elementos suelen comportarse según las condiciones como metales o como no metales; a estos se les conoce como METALOIDES.En la clasificación periódica de DIECIOCHO columnas podemos apreciar a estos grupos de elementos claramente delimitados, lo cual nos parece razonable si pensamos que las características de ellos dependen de la distribución electrónica, entre más próximos estén los elementos, mayor semejanza tendrán en sus propiedades y esto se debe a que la distribución electrónica presenta también una gran semejanza.Si admitimos que las propiedades químicas de los elementos dependen de la ubicación de los electrones en su envoltura, tenemos una CLASIFICACION DE ELEMENTOS EN FUNCION DE SU DISTRIBUCION ELECTRONICA. En esta clasificación los elementos se agruparon en cuatro bloques según el tipo de orbital atómico en que se ubique su electrón diferencial.Otra clasificación que resulta importante conocer y es de gran utilidad en la NOMENCLATURA es la que nos brinda información sobre la capacidad de combinación de los elementos o sea su VALENCIAasí como su ESTADO o NUMERO DE OXIDACION.Existe una clasificación que ubica a los elementos representativos en ocho grupos identificados como A y a los de transición en B. Los elementos representativos son conocidos así porque el número de grupos representa la cantidad de electrones en su CAPA DE VALENCIA o sea el ULTIMO NIVEL y la cantidad de electrones en esa capa nos indica la valencia máxima que el elemento puede presentar. LaVALENCIA de un elemento se refiere a la capacidad de combinación que presenta; en el caso de los NO METALES se relaciona con el número de átomos de hidrógeno con que se puede enlazar y en los METALES con cuántos átomos de cloro se une.Ejemplos: El Calcio se puede unir a dos átomos de Cloro por lo que su valencia es dos. CaCl2El Oxígeno forma agua uniéndose a dos hidrógenos, su valencia también será dos. H2OEl Nitrógeno se une a tres Hidrógenos en la formación de Amoníaco,su valencia es tres. NH3
sábado, 24 de marzo de 2012
Clasificación de la materia
Clasificación de la materia
La materia se clasifica en sustancias puras y mezclas. Las sustancias puras, que a su vez pueden ser simples y compuestas, se caracterizan por tener composiciones fijas y responder a propiedades constantes. Las sustancias compuestas pueden separarse mediante procedimientos químicos.
Las mezclas están formadas por dos o más sustancias puras y se dividen en homogéneas y heterogéneas. Los componentes de una mezcla se pueden separar utilizando procesos físicos.
Sustancias puras
Una sustancia es cualquier variedad de la materia de aspecto homogéneo que comparte determinadas propiedades, como el color, la densidad, la temperatura de ebullición y la temperatura de fusión, entre otras. Esto hace que cada sustancia pueda distinguirse de otra sustancia.
Las sustancias simples están formadas por átomos de un solo elemento que no pueden fragmentarse en elementos más simples utilizando métodos físicos o químicos comunes. Son sustancias simples los elementos que figuran en la tabla periódica de los elementos, como el oxígeno, el carbono, el nitrógeno, el azufre, etc.
Las sustancias compuestas son aquellas sustancias puras que contienen dos o más elementos fijos, con lo cual siempre tienen los mismos elementos en su composición. Las sustancias compuestas se representan por medio de fórmulas químicas. La molécula del agua está formada por dos átomos de hidrógeno y uno de oxígeno. El dióxido de carbono posee dos átomos de oxígeno y uno de carbono. Además del agua y del dióxido de carbono, son ejemplos de sustancias compuestas el metano, el cloruro de sodio, la glucosa, la urea, el amoníaco y el alcohol etílico.
Para separar los elementos de una sustancia compuesta se puede recurrir a procesos químicos. Por ejemplo, sometiendo a elevadas temperaturas al dióxido de mercurio es posible obtener los elementos constituyentes de dicha sustancia. Otra forma de separación es la electrólisis, que consiste en someter a un determinado compuesto a una corriente eléctrica. La electrólisis del agua separa sus elementos constituyentes, obteniéndose los gases hidrógeno y oxígeno. La utilización de procesos químicos de separación produce destrucción de las sustancias componentes.
Mezclas
Son materiales que se forman al combinar dos o más sustancias puras, sin que ello ocasione cambios químicos en esas sustancias. Por medio de métodos físicos, las mezclas pueden separarse de sus componentes sin producir alteración en los mismos. Existen dos tipos de mezclas, las homogéneas y las heterogéneas.
Las mezclas homogéneas son soluciones, formadas por un solvente generalmente en mayor proporción y uno o más solutos en cantidades menores. Tienen la misma composición en toda la muestra por lo que son uniformes, con lo cual presentan una sola fase. Sus partículas, que no pueden distinguirse a simple vista ni aún bajo el microscopio, se mueven al azar y de manera constante. Tienen un tamaño entre 0,1 y 10 nanómetros (nm) y se encuentran dispersadas como moléculas, átomos o iones.Las mezclas homogéneas son transparentes y sus componentes no se separan durante el reposo. La soda es una solución formada por un solvente, el agua, y un soluto, el dióxido de carbono.
Las mezclas heterogéneas son aquellas donde sus componentes pueden distinguirse a simple vista o con el microscopio, con lo cual no son uniformes. Por ejemplo la arena en agua, o piedras con carbón son mezclas heterogéneas groseras que se aprecian fácilmente y varían de un punto a otro. Además, dentro de las mezclas heterogéneas se distinguen las suspensiones y los coloides. Las suspensiones son mezclas heterogéneas formadas por una fase dispersa, es decir, un soluto sólido insoluble y una fase dispersante, representada por un líquido. Las partículas de la fase dispersa son mayores a 100 nanómetros de tamaño, pueden observarse a simple vista y sedimentan cuando la suspensión está en reposo. Las suspensiones tienen aspecto opaco como el aceite en agua, los jugos de frutas, la arcilla en agua y las pinturas al agua.
Los coloides son mezclas heterogéneas cuyas partículas, entre 10 y 100 nanómetros, son más pequeñas que las correspondientes a las suspensiones, pero más grandes que las moléculas que forman las soluciones. Un coloide es un sistema formado por una fase continua, en general líquida, y otra fase dispersa a modo de partículas, normalmente sólidas. Sus partículas no se separan si están en reposo y poseen una opacidad menor que las suspensiones. Los coloides también tienen una fase dispersa representada por partículas del tamaño antes indicado que se distribuyen en una fase dispersante, similar al solvente de las soluciones. Son mezclas heterogéneas coloidales la sangre, la leche, el flan, las gelatinas, el vino, la cerveza, la tinta china, las pinturas, la mayonesa, la clara de huevo, el humo y la neblina.
jueves, 22 de marzo de 2012
IONES
IONES
Son átomos, o grupos de ellos, que han per -
dido o ganado uno o mas electrones de ma -
nera que adquieren una carga eléctrica positiva
o negativa respectivamente. Su existencia
se debe al bombardeo de la atmósfera por los
rayos cósmicos u otra fuente alta de energía,
como la radiactividad.
En su estado natural, los átomos y las molé -
culas tienden a neutralizarse con la concu -
rrencia de tantos iones positivos como negativos.
Sin embargo, la actividad meteorológica
altera ese equilibrio de forma constante por
medio de tormentas y vientos dominantes.
QUÉ ES UN ELECTRON?
Se conoce como electrón a la partícula elemental más ligera que constituye a los átomos y que presenta la mínima carga posible de electricidad negativa. Se trata de una partícula subatómica que rodea al núcleo del átomo, que está compuesto por protones yneutrones.
Los electrones definen las atracciones entre los átomos y generan, a través de su movimiento, corriente eléctrica en la mayoría de los metales. Fueron descubiertos por el físico británico Joseph John Thomson (1856-1906), aunque su existencia ya había sido postulada por el científico George Johnstone Stoney (1826-1911).
El microscopio
APRENDIENDO MÁS.....

El microscopio es un elemento imprescindible en el Laboratorio de Ciencias Naturales, por lo tanto es necesario conocer bien sus partes y su funcionamiento.
PARTES DEL MICROSCOPIO:
OBJETIVOS
Son los grupos de lentes principales, es decir, los que determinan
realmente el aumento máximo y el poder de resolución del microscopio. Cada objetivo lleva una inscripción formada por dos
números separados por una barra. El primero, más grande, indica el número de aumentos del objetivo. El segundo se denomina
apertura numérica y es una medida de la luminosidad del objetivo. Cuanto menor es la apertura numérica de un objetivo, mayor
es la cantidad de luz que atraviesa el objetivo.
Los objetivos de mayor aumento (40x y 100x habitualmente) tienen el extremo retráctil para protegerlos es caso de choque contra la preparación, ya que para enfocarlos hay que acercarlos
mucho a la misma.
Los objetivos de gran aumento sólo pueden ser utilizados si se
interpone entre el objetivo y la preparación una gota de un líquido
que tenga el mismo índice de refracción que el vidrio (generalmente aceite de cedro) por lo que se denominan objetivos de inmersión.
OCULAR
Es el otro grupo de lentes del microscopio. Aumenta la imagen
formada por el objetivo. En su parte superior lleva una inscripción
que indica el aumento que produce.
ESPEJO
Sirve como fuente de luz al reflejar la de un foco externo. Tiene
dos caras, una plana y otra cóncava para concentrar más la luz.
En algunos microscopios es sustituido por una lámpara que se
conecta a la red.
PORTAFILTROS
Soporte que admite filtros de vidrio de diversos colores. Estos
filtros se utilizan para suavizar la luz o para aumentar el contraste
DIAFRAGMA
Está formado por un conjunto de laminillas que dejan un orificio
en su centro. El diámetro del orificio puede ser variado mediante
una palanca, con lo que se regula la cantidad de luz que llega a
la preparación.
BRAZO Sirve de soporte a los otros elementos del microscopio. Está articulado con el pie para poder inclinarlo y hacer así más cómoda la
observación.
CONDENSADOR
Es un sistema de lentes situado debajo de la platina que concentra la luz sobre la preparación, consiguiéndose así una iluminación más intensa.
PIE
CHARNELA
Es el punto de articulación entre el brazo y el pie. Permite inclinar
el microscopio para hacer más cómoda la observación.
TUBO
Es un tubo hueco que separa los dos grupos de lentes (ocular y
objetivo).
REVÓLVER PORTAOBJETIVOS
Permite colocar en posición de trabajo a los distintos objetivos
con que cuenta el microscopio. Presenta unas ranuras que facilitan la fijación del objetivo en la posición correcta.
TORNILLO DEL CONDENSADOR Permite subir o bajar el condensador respecto a la platina para
mejorar la iluminación
TORNILLO DE ENFOQUE
(MACROMÉTRICO)
Acerca o aleja rápidamente el objetivo a la preparación para
hacer un enfoque aproximado. Se usa sólo con los objetivos de
menor aumento.
TORNILLO MICROMÉTRICO
Permite enfocar con precisión, moviendo muy lentamente el objetivo.
PLATINA
Es la superficie sobre la cual se colocan las preparaciones. Tiene
un orificio en su centro para permitir el paso de la luz. En algunos
microscopios está dotada de un sistema con dos tornillos que
permiten el desplazamiento preciso de la preparación.
PINZAS Sirven de sujeción de la preparación sobre la platina
miércoles, 21 de marzo de 2012
Estructura y composición de la materia
MATERIA
La materia es todo lo que ocupa un lugar en el espacio. La materia es todo aquello que se forma a partir de átomos o moléculas, y con la propiedad de encontrarse en estado sólido, líquido o gaseoso. Como lo mostramos anteriormente ahora conoceremos que es un átomo y molécula.
ÁTOMO
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo.Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo. Los electrones van llenando los orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa forma, el último nivel que contenga electrones puede estar completo o incompleto. Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica. El átomo que gana electrones (queda cargado negativamente) se denomina anión. El átomo que pierde electrones (queda cargado positivamente) se llama catión. Tanto el anión como el catión reciben el nombre de "iones". Es decir, un ion es un átomo cargado eléctricamente, sea en forma positiva o negativa.
MOLÉCULA
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia.Conformada por átomos. Por ejemplo, la menor porción de agua que puede existir en estado libre y conservar las propiedades del agua es la formada por 1 átomo de oxígeno y 2 de hidrógeno. La molécula es una estructura formada a partir de la unión de dos o más átomos que comparten electrones. A temperatura ambiente hay moléculas sólidas (cloruro de sodio o sal común), líquidas (agua) y gaseosas (dióxido de carbono). En síntesis, la materia está formada por partes muy pequeñas llamadas átomos. Los átomos se reúnen para constituir moléculas. A su vez, las moléculas se unen para formar sustancias.
La materia es todo lo que ocupa un lugar en el espacio. La materia es todo aquello que se forma a partir de átomos o moléculas, y con la propiedad de encontrarse en estado sólido, líquido o gaseoso. Como lo mostramos anteriormente ahora conoceremos que es un átomo y molécula.
ÁTOMO
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo.Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo. Los electrones van llenando los orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa forma, el último nivel que contenga electrones puede estar completo o incompleto. Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica. El átomo que gana electrones (queda cargado negativamente) se denomina anión. El átomo que pierde electrones (queda cargado positivamente) se llama catión. Tanto el anión como el catión reciben el nombre de "iones". Es decir, un ion es un átomo cargado eléctricamente, sea en forma positiva o negativa.
MOLÉCULA
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia.Conformada por átomos. Por ejemplo, la menor porción de agua que puede existir en estado libre y conservar las propiedades del agua es la formada por 1 átomo de oxígeno y 2 de hidrógeno. La molécula es una estructura formada a partir de la unión de dos o más átomos que comparten electrones. A temperatura ambiente hay moléculas sólidas (cloruro de sodio o sal común), líquidas (agua) y gaseosas (dióxido de carbono). En síntesis, la materia está formada por partes muy pequeñas llamadas átomos. Los átomos se reúnen para constituir moléculas. A su vez, las moléculas se unen para formar sustancias.
martes, 20 de marzo de 2012
CÓMO SE HACE EL JABÓN?
El jabón generalmente es el resultado de la reacción química entre un álcali (generalmente hidróxido de sodio o de potasio) y algún ácido graso; esta reacción se denomina saponificación. El ácido graso puede ser, por ejemplo, la manteca de cerdo o el aceite de coco. El jabón es soluble en agua y, por sus propiedades detersivas, sirve comúnmente para lavar.
Tradicionalmente es un material sólido, lo que hace un contraste entre ellos aunque también es habitual verlo en forma líquida o en polvo. En realidad la forma sólida es el compuesto "seco" o sin el agua que está involucrada durante la reacción mediante la cual se obtiene el jabón, y la forma líquida es el jabón "disuelto" en agua, en este caso su consistencia puede ser muy viscosa o muy fluida. El jabón está hecho con las grasas de distintos animales y plantas.
Tipos
Existen diversos tipos de jabón, enumeramos algunos:
Acción detergente
Los jabones ejercen su acción limpiadora sobre las grasas en presencia del agua debido a la estructura de sus moléculas. Éstas tienen una parte liposoluble y otra hidrosoluble.
El componente liposoluble hace que el jabón moje la grasa disolviéndola y el componente hidrosoluble hace que el jabón se disuelva a su vez en el agua.
Las manchas de grasa no se pueden eliminar sólo con agua por ser insolubles en ella. El jabón en cambio, que es soluble en ambas, permite que la grasa pase a la disolución desapareciendo la mancha de grasa.
Cuando un jabón se disuelve en agua disminuye la tensión superficial de ésta, con lo que favorece su penetración en los intersticios de la sustancia a lavar. Por otra parte, los grupos hidrofóbicos del jabón se disuelven unos en otros; mientras que los grupos hidrofílicos se orientan hacia el agua generando un coloide, es decir, un agregado de muchas moléculas convenientemente orientadas. Como las micelas coloidales están cargadas y se repelen mutuamente, presentan una gran estabilidad.
Métodos de obtención
En esencia el proceso de obtención del jabón, sea industrial o artesano, consta de tres fases:
1) saponificación, 2) sangrado y 3) moldeado.
- Se hierve la grasa en grandes calderas, se añade lentamente sosa cáustica (NaOH) y se agita continuamente la mezcla hasta que comienza a ponerse pastosa. La reacción que ha tenido lugar recibe el nombre de saponificación y los productos son el jabón y la lejía residual que contiene glicerina: grasa + sosa → jabón + glicerina
- El jabón obtenido se deposita en la superficie en forma de gránulos. Para que cuaje de una manera completa se le añade sal común(NaCl). Esta operación recibe el nombre de sangrado o salado; con ella se consigue la separación total del jabón (que flotará sobre la disolución de glicerina), de sosa (que no ha reaccionado) y de agua.
- Ya habiendo realizado el sangrado, el jabón se pasa a otro recipiente o vasija donde se le pueden añadir perfumes, colorantes, productos medicinales, etc. Entonces, todavía caliente, se vierte en moldes, se deja enfriar y se corta en pedazos.
El jabón líquido está constituido principalmente por oleato de potasio, preparado por la saponificación del ácido oleico con hidróxido de potasio. También es muy usado (por ser más económico), el Estearato de sodio o palmilato de sodio, análogo al anterior, usando ácido estearílico, esteárico o palmítico e hidróxido sódico, respectivamente.
En la actualidad hay dos métodos de obtención del jabón, ambos basados en la saponificación.
lunes, 19 de marzo de 2012
sabias que el refresco puede....?
SABIAS QUE ...Consumir en exceso bebidas con gas como los refrescos puede causar taquicardias, debilidad ósea y parálisis muscular, entre otros problemas de salud ya que ,Una lata de Coca-Cola contiene aproximadamente, diez cucharillas de azúcar, que resultan perjudiciales para la salud de los más pequeños. Por esta razón, comenzaron los conflictos entre la Organización Mundial de la Salud (OMS) y las grandes transnacionales ligadas al azúcar. En el 2003, la OMS intentaba publicar un informe sobre los peligros del consumo excesivo de azúcar..
cuidate!!
sábado, 17 de marzo de 2012
gaseoso
Coca-Cola® con gas
Indagando ...
Se sabe que una gaseosa contiene 1cierta cantidad de gas a una presión mayor que la presión atmosférica. Si se aumenta la temperatura, la cantidad de gas disuelto disminuye.
¿Qué vamos a hacer?
Recogeremos e identificaremos el dióxido de carbono disuelto en una gaseosa y comprobaremos sus propiedades ácidas.
Materiales
-
Plastilina
-
Solución de agua de cal (solución saturada de hidróxido de calcio)
-
Solución alcalina con indicador
-
Coca-Cola pequeña, helada
-
Azúcar
-
Botella de gaseosa de 1 L, vacía
-
Cubeta o recipiente de plástico
-
Cinta de enmascarar
Dos recipientes de plástico pequeños (se pueden obtener recortando la parte inferior de una botellita de agua mineral)
Espatula de madera
Manguera plástica delgada de 45 cm
-
Procedimiento
-
Llena con agua la botella plástica de un litro e inviértela en la cubeta
-
Coloca plastilina en un extremo de la manguera y el extremo libre introdúcelo
dentro de la botella invertida
-
Destapa la gaseosa, adiciona una pequeña cantidad de azúcar e inmediatamente
coloca el extremo de la manguera con la plastilina como se muestra en la figura
-
Observa el desprendimiento de gas y su acumulación en la botella invertida
-
Cuando la producción de gas sea lenta, marca con la cinta de enmascarar en el
punto que delimita el volumen de gas recogido y, sin sacar la botella invertida,
introduce el otro extremo de la manguera dentro del recipiente con solución de
agua de cal. Observa qué ocurre
-
Retira de la solución de cal el extremo libre de la manguera e introdúcelo en la
solución alcalina . Observa qué sucede
- Retira la botella de la cubeta y llénala con agua hasta el punto marcado con la cinta. Mide el volumen de agua utilizando una probeta.
¿Qué pasó?
El dióxido de carbono disuelto en la gaseosa reacciona con el agua de cal para dar carbonato de calcio, reacción característica para identificar el CO2:
Ca(OH)2 (ac) + CO2 (g) → CaCO3 (s) + H2O (l)
En la segunda parte del experimento se tiene una solución básica de color rosado debido a que contiene un indicador (fenolftaleína). Esta solución se torna incolora cuando el dióxido de carbono entra en contacto con ella, indicando que el gas tiene la capacidad de neutralizarla. El cambio de color corrobora el carácter ácido del gas.
Para pensar ...
El dióxido de carbono disuelto en la gaseosa reacciona con el agua de cal para dar carbonato de calcio, reacción característica para identificar el CO2:
Ca(OH)2 (ac) + CO2 (g) → CaCO3 (s) + H2O (l)
En la segunda parte del experimento se tiene una solución básica de color rosado debido a que contiene un indicador (fenolftaleína). Esta solución se torna incolora cuando el dióxido de carbono entra en contacto con ella, indicando que el gas tiene la capacidad de neutralizarla. El cambio de color corrobora el carácter ácido del gas.
Para pensar ...
-
¿Qu volumen de gas recolectaste de tu gaseosa? Compara con el volumen
recogido por otros grupos
-
¿Cuál es la función del azúcar?
-
¿Será igual la cantidad de gas disuelto en las gaseosas envasadas en Medellín
que en las envasadas en Barranquilla?
- ¿Para qué se le adiciona dióxido de carbono a las gaseosas? ¿Solamente para que produzcan espuma?
Suscribirse a:
Entradas (Atom)

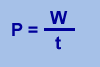










+20.25.30.png)